在免疫系统中,通常是由B细胞和T细胞这两种主要淋巴细胞协同作用来抵御外来病菌的侵入。然而,在某些敏感人群中,淋巴细胞可能会将自身的某些特定物质识别为抗原进行攻击,进而引起相关疾病。I型糖尿病(Type 1 diabetes, T1D)就是由于免疫系统攻击胰脏内的胰岛β细胞,从而导致患者体内胰岛素缺失、血糖水平过高的一种自身免疫性疾病。目前T1D的发病率在全球呈显著上升趋势,每100位糖尿病患者中就有约5位T1D患者,尤其在儿童及青少年糖尿病患者中,T1D所占比例高达80%~90%。在T1D患者体内,胰岛素、谷氨酸脱酸酶(GAD65)、热休克蛋白(HSP)、人锌转运体8(ZnT8)等均可被识别成抗原。目前,T1D的治疗主要依赖于外源性胰岛素注射,但该疗法无法精准调控机体血糖水平,存在低血糖等副作用。因此,寻找和开发新的治疗方法是T1D患者的迫切需求。
2019年,Abdel Rahim A. Hamad团队和周如鸿教授团队发现了一种新的自身抗原X-autoantigen(也称X-idiotype),X-autoantigen结合抗原呈递蛋白HLA-DQ8(T1D的主要风险等位基因)的能力比胰岛素强约1000倍(Cell 2019),但至今仍不太清楚其分子机理。2023年4月11日,浙江大学周如鸿教授团队与约翰霍普金斯大学医学院Hamad团队合作,在国际权威期刊 PNAS 发表论文,深入研究了X-autoantigen与HLA-DQ8相互作用的机制,并设计出一系列可被应用为HLA阻滞剂或TCR功能调节剂的自身抗原,为开发更有效、更安全、更个体化的免疫疗法提供了新思路。

首先,作者团队使用全原子分子动力学模拟了自身抗原X-autoantigen与HLA-DQ8的动态相互作用。通过对HLA与抗原进行接触分析,作者团队设计了相关表位处的点突变。作者团队通过点突变的自由能微扰(FEP)计算结果发现抗原核心表位p4位置上的甲硫氨酸Met残基(Met4)如果突变为异亮氨酸Ile(M4I)或亮氨酸Leu(M4L),就能够增加抗原与HLA的结合亲和力(图1)。从结构细节图中可以观察到Met4残基深埋在HLA中,并与HLA二硫键以及疏水残基接触。将Met4突变为疏水残基后的M4I和M4L能减少与二硫键原子的冲突,从而提升亲和力。

图1 自身抗原X-autoantigen突变后的HLA-antigen(pHLA)二体结合自由能变化
在此基础上,作者团队采用了交换突变、双重突变的方法进行研究,得到可增强抗原与HLA结合亲和力的突变体。在最初设计的残基交换突变结果中,提高X-autoantigen与HLA结合亲和力最多的两个突变体是Val5 -> Tyr + Tyr6 -> Val (V5Y_Y6V) 和 Tyr6 -> Val + Tyr7 -> Val (Y6V_Y7V)(图1C)。作者团队进一步探索了Val5-Tyr6-Tyr7三联体的有利双突变。从有利双突变的能量贡献度分解来看,核心表位p6位置上的Tyr(Tyr6)突变对增强抗原与HLA的结合亲和力起关键性作用(图2)。计算结果显示,突变体亲和力与残基体积呈适度的相关性(R2 = 0.37),但与Eisenberg疏水性没有相关性(R2 = 0.02)。
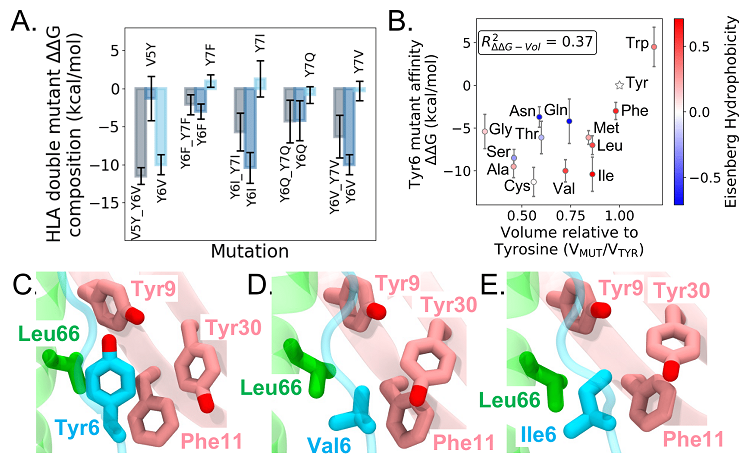
图2 X-autoantigen双突变能量贡献度分解及p6位置上Tyr6突变的自由能变化结果
基于以上对HLA-antigen(pHLA)的分析,作者团队进一步探究了抗原突变对pHLA-TCR结合的影响(图3)。计算结果表明,Tyr6突变体Y6C和Y6I能增强pHLA与TCR的结合亲和力,可作为调节TCR功能的候选药物。另一方面,不利的TCR结合可以降低自身免疫性疾病的发生风险,就这种情况而言,突变体V5Y_Y6V、Y6Q_Y7Q更加有效。Y6V、Y6V_Y7V等对pHLA二体结合力增强,但与TCR三体结合亲和力影响不大的突变体,也可被用作HLA阻断剂。总的来说,上述分析揭示了核心表位p6突变为较小的疏水/亲水残基可改善X-autoantigen与HLA-DQ8的结合亲和力。同时,p6突变体(Y6V),p5-p6交换突变体(V5Y_Y6V)和p6-p7双突变体(Y6Q_Y7Q)可被用作调节pHLA-TCR结合的潜在治疗性药物。
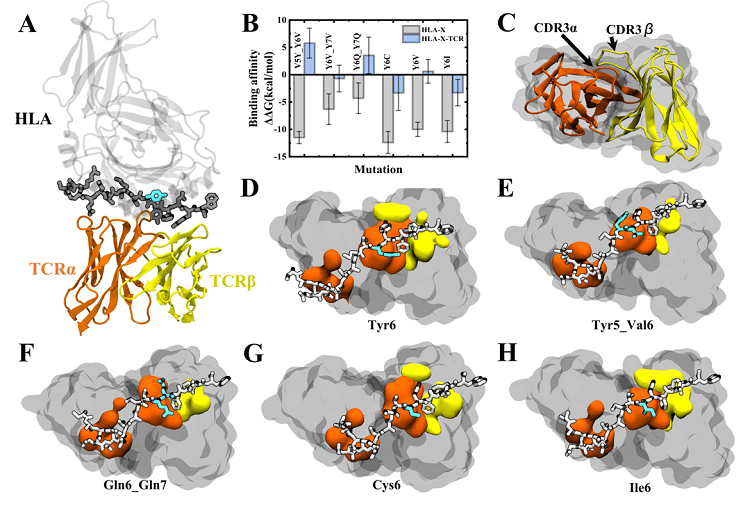
图3 X-autoantigen Tyr6突变对pHLA与TCR结合亲和力的影响
为了验证计算机预测结果,作者团队还进行了基于CFSE的T细胞增殖实验(图4)。从实验结果来看,突变体 M2 (Y6V_Y7V)、M3 (Y6Q_Y7Q)、M4 (Y6C) 和 M5 (Y6V) 对pHLA-TCR亲和力的预测效果与 CD4 T 细胞增殖的情况一致(相对于X-autoantigen),证明至少4条设计的自身抗原短肽显示了良好的实验验证结果。综上所述,作者团队使用理论与实验相结合的方法,对T1D 患者身上发现的 X-autoantigen自抗原进行突变分析,优化设计出了新型抗原。这项研究为开发全新自身抗原免疫疗法提供了一种新的思路。
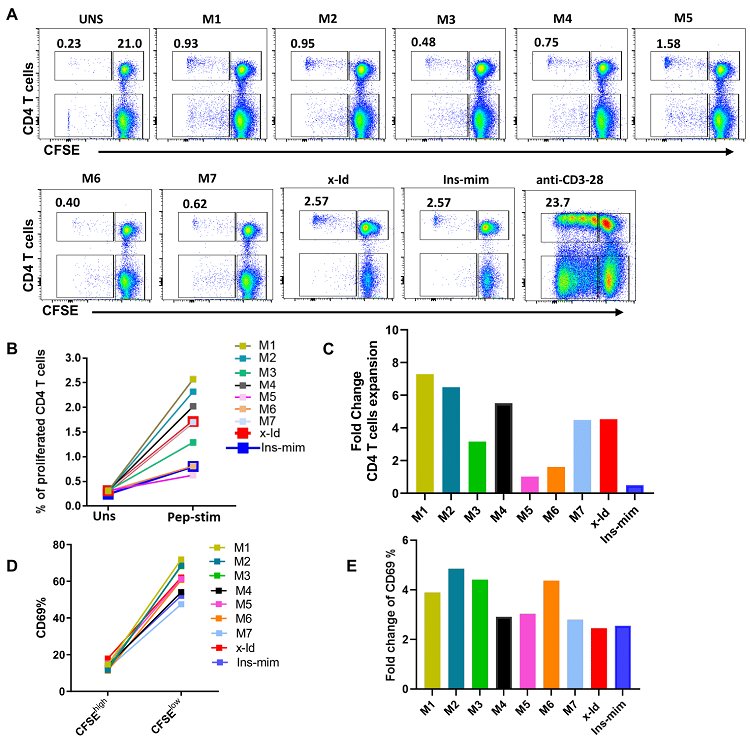
图4 X-autoantigen突变体的T细胞增殖实验结果
该工作与约翰霍普金斯大学医学院合作完成,浙江大学定量生物中心博士生宋伊、原IBM托马斯-J-沃森研究中心博士后David Bell为共同第一作者,浙江大学周如鸿教授为论文通讯作者。浙江大学定量生物中心博士后陈骏、IBM托马斯-J-沃森研究中心博士后Sangyun Lee也参与了本工作。
这项工作得到了国家重点研发计划(2021YFF1200404和2021YFA1201200),国家自然科学基金(U1967217),中央高校基础研究基金(226-2022-00043,226-2022-00192),国家自主创新示范区上海张江重大项目(ZJZX2020014),浙江大学上海高等研究院繁星基金(SN-ZJU-SIAS-003),以及W.M. Keck基金会(2019-2022)的资助。
原文(扫描二维码,识别后直达原文页面):

A mutagenesis study of autoantigen optimization for potential T1D vaccine designYi Song, David R. Bell, Rizwan Ahmed, Kevin C. Chan, Sangyun Lee, Abdel Rahim A. Hamad, and Ruhong ZhouPNAS, 2023, 120, e2214430120, DOI: 10.1073/pnas.2214430120
相关论文:
1. Ahmed R, Omidian Z, Giwa A, Cornwell B, Majety N, Bell DR, Lee S, Zhang H, Michels A, Desiderio S, Sadegh-Nasseri S, Rabb H, Gritsch S, Suva ML, Cahan P, Zhou R, Jie C, Donner T, Hamad ARA. A Public BCR Present in a Unique Dual-Receptor-Expressing Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen. Cell, 2019, 177(6):1583-1599.e16. DOI: 10.1016/j.cell.2019.05.007.
2. Hölzemer A, Thobakgale CF, Jimenez Cruz CA, Garcia-Beltran WF, Carlson JM, van Teijlingen NH, Mann JK, Jaggernath M, Kang SG, Körner C, Chung AW, Schafer JL, Evans DT, Alter G, Walker BD, Goulder PJ, Carrington M, Hartmann P, Pertel T, Zhou R, Ndung'u T, Altfeld M. Selection of an HLA-C*03:04-Restricted HIV-1 p24 Gag Sequence Variant Is Associated with Viral Escape from KIR2DL3+ Natural Killer Cells: Data from an Observational Cohort in South Africa. PLoS Med. 2015 12 (11), e1001900.


