多胺是一类含有两个或多个氨基的化合物,精确调节人体细胞内多胺稳态是维持细胞健康所必需的。多胺稳态主要依赖于两个系统:一个是代谢系统,用以调节多胺的产生和降解,一个是运输系统,用来决定细胞多胺的分布。溶酶体转运体ATP13A2可将多胺从溶酶体输出到细胞质,在平衡胞浆和溶酶体间多胺浓度方面起着至关重要的作用。人类ATP13A2 (hATP13A2) 基因异常与多种疾病相关,包括Kufor-Rakeb综合征(一种青少年发病的帕金森病)和常染色体隐性痉挛性截瘫78。虽然ATP13A2在多胺稳态中起着关键作用,但是其分子机制仍不清楚。2023年4月8日,浙江大学生命科学学院、浙江大学上海高等研究院周如鸿教授、王勇研究员联合南方科技大学刘忠民课题组、中山大学李惠琳课题组在《自然•通讯》(Nature Communications)上发表了研究论文,通过冷冻电镜技术捕获了hATP13A2转运多胺过程的几乎整个构象循环的多个不同状态下的高分辨率原子结构(图1),结合多尺度分子动力学模拟和质谱技术,揭示了多胺转运的分子机制,为人类ATP13A2的多胺底物募集、转运和释放提供了结构基础。这将有助于我们理解hATP13A2在神经元疾病中的致病机制,对合理的药物设计具有重要的指导意义。
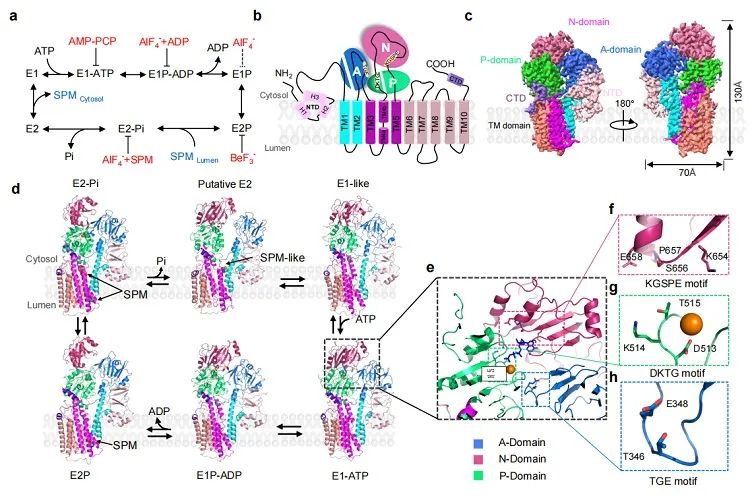
图1 人ATP13A2多个状态的冷冻电镜结构
1. 多胺募集。底物从管腔侧运输到胞质侧的第一步是将多胺募集到hATP13A2蛋白上。团队在hATP13A2的E2P冷冻电镜结构中发现了一个位于内/溶酶体腔层侧的狭长的结合口袋,具有向外开放的结构。并通过分子动力学模拟验证了它就是多胺招募的入口位点。
2. 多胺转运。伴随着去磷酸化水解过程的能量释放,磷酸化的hATP13A2从E2P状态切换到E2-Pi状态,驱动底物从胞浆侧到另一侧的移动。虽然冷冻电镜结构并不能非常清晰的捕获到多胺在该状态下的结合位置,但是团队进一步通过粗粒化分子动力学模拟、突变功能实验和交联质谱技术,确认了多胺的第二个底物结合位点就位于胞内侧,因此,首次捕获了多胺转运过程中的关键中间态。
3. 多胺释放。伴随着磷酸根离子的释放,hATP13A2进入底物释放前的E2状态。团队在冷冻电镜电子密度图里观察到,在底物释放口袋附近有大量的比较动态的脂质类似物。为了进一步验证这一猜测,团队通过粗粒化分子动力学模拟来研究脂质和多胺的相互作用(图2),发现这些脂质确实非常有可能是带强负电的磷脂,特别是磷脂酰肌醇4,5-二磷酸(PIP2)。最后,通过全原子分子动力学模拟,团队还发现了第三个高度水合的多胺结合位点。因此,最终揭示了一条完整的多胺转运路径。
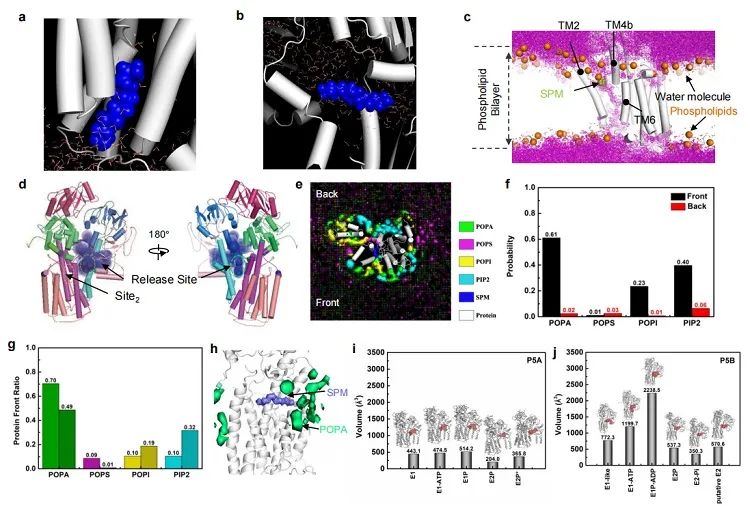
图2 多胺与脂质相互作用及结合位点的分析
综上所述,团队通过结构生物学和计算生物学手段,解析和模拟了人多胺转运蛋白ATP13A2的整个构象循环的一系列构象状态,并揭示了底物多胺分子的转运机制(图3),为后续的基于结构的理性药物设计提供了指导。
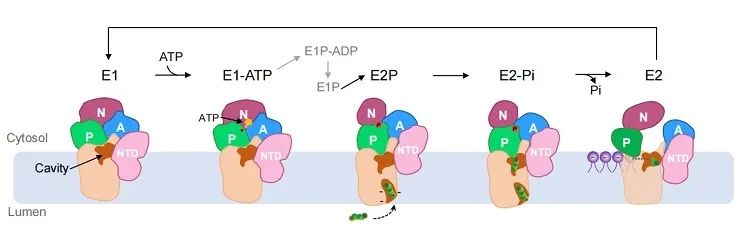
图3 hATP13A2转运多胺的模型
南方科技大学穆建强、薛晨阳博士和浙江大学生命科学学院博士后付蕾为论文的共同第一作者,浙江大学生命科学学院王勇研究员和南方科技大学刘忠民教授为论文的共同通讯作者。本工作得到了周如鸿教授及其团队陈骏博士的支持。这项工作是计算生物学+结构生物学等多学科领域交叉融合的研究成果,得到了国家十四五重点研发计划“生物与信息融合”专项、国家自然科学基金、国家自主创新示范区上海张江重大专项、浙江大学上海高等研究院繁星科学基金等资助。
原文(扫描二维码,识别后直达原文页面):

Conformational cycle of human polyamine transporter ATP13A2Jianqiang Mu, Chenyang Xue, Lei Fu, Zongjun Yu, Minhan Nie, Mengqi Wu, Xinmeng Chen, Kun Liu, Ruiqian Bu, Ying Huang, Baisheng Yang, Jianming Han, Qianru Jiang, Kevin C. Chan, Ruhong Zhou, Huilin Li, Ancheng Huang, Yong Wang & Zhongmin LiuNat. Commun., 2023, 14, 1978, DOI: 10.1038/s41467-023-37741-0


