糖尿病是一种以高血糖为特征的代谢性疾病,目前全球糖尿病患者总数超 5.37 亿人,国内糖尿病患者总数达 1.4 亿人,得到有效血糖控制的患者仅占 6%。作为糖尿病的主要类型之一,1 型糖尿病(T1D)的发病率近年来呈显著上升趋势,每 100 名糖尿病患者中约有 5 名 T1D 患者,而在儿童及青少年糖尿病患者中 T1D 的占比高达 80%~90%。
现阶段,针对 T1D 的治疗大都依赖于外源性胰岛素注射,但该方法难以精准调控机体血糖水平,且容易出现低血糖等副作用,目前医学界正积极寻找和开发 T1D 的新治疗方法。
近期,浙江大学周如鸿团队基于前期研究设计出了多种可被应用为人类白细胞抗原(HLA)阻滞剂或 T 细胞抗原受体(TCR)功能调节剂的自身抗原,有望开发成 T1D 潜在新抗原疫苗。目前,这项研究已经以“A mutagenesis study of autoantigen optimization for potential T1D vaccine design”为题发表在 PNAS 上。

(来源:PNAS)
“我们的这项研究采用理论与实验相结合的方法,针对先前发现的自身抗原 X-autoantigen 进行了突变分析,优化设计出了新型抗原,为下一步开发更加有效、安全和个体化的自身抗原免疫疗法提供新思路。”浙江大学上海高等研究院周如鸿教授告诉生辉。
周如鸿本科毕业于浙江大学物理系,在美国哥伦比亚大学化学系获得生物物理化学博士学位。回国前他曾在 IBM Watson 研究中心先后担任研究员、杰出研究员、IBM 蓝色基因计划首席科学家等,还曾担任哥伦比亚大学化学系兼职教授。
2020 年,周如鸿全职回到浙江大学,参与筹建浙江大学定量生物中心与浙江大学上海高等研究院,担任浙江大学上海高等研究院院长、浙江大学生命科学学院院长,继续从事计算生物与生物物理等前沿领域的研究工作。
截至目前,周如鸿已在 Science、Nature、Cell、PNAS 等发表论文 300 余篇,拥有或已申请国际专利 32 项。现阶段,他课题组的研究工作集中在蛋白质设计、纳米药物设计、肿瘤免疫机制等领域。

▲图|浙江大学上海高等研究院院长周如鸿教授(来源:受访者)

理论实验结合设计出 T1D 潜在新抗原疫苗
在人体免疫系统中,通常由 B 细胞和 T 细胞两种主要的淋巴细胞协同作用抵御外来病菌的侵入,而在某些敏感人群中,淋巴细胞可能会将自身的某些特定物质识别为抗原并进行攻击,进而引起相关疾病。
作为一种自身免疫性疾病,T1D 患者的免疫系统攻击胰脏内的胰岛 β 细胞导致体内胰岛素缺失、血糖水平过高。“在 T1D 患者体内,胰岛素、谷氨酸脱酸酶(GAD65)、热休克蛋白(HSP)、人锌转运体 8(ZnT8)等均可被识别成抗原。”周如鸿指出。
“目前传统 T1D 疗法的重点在于管理血糖水平,促进胰岛素替代,并缓解相关的并发症。”他说道。比如,外源性胰岛素治疗,即通过注射、胰岛素泵以及人工胰腺系统模仿身体的自然胰岛素分泌模式,或通过算法自动调整胰岛素的输送,满足进食或纠正高血糖水平,此外,其他疗法还包括胰腺移植、胰岛细胞移植等。
由于 T1D 患者无法产生胰岛素,胰岛素替代疗法需要持续监测、精确给药,并不断调整用药剂量,避免低血糖症或高血糖症;同时,个体差异造成患者需要个性化定制治疗方案,在调控血糖水平的同时还面临糖尿病视网膜病变、肾病、神经病变和心血管疾病等并发症,增加了预防和治疗的难度。
“抗原免疫疗法是近年来新兴的一种治疗手段,即通过靶向与 T1D 相关的自身抗原,调节或抑制负责破坏产生胰岛素的 β 细胞的自身免疫反应来解决 T1D 产生的根本原因。”他指出,“不仅如此,抗原免疫疗法可针对个体的特定自身抗原进行定制,实现个性化治疗,而且还很容易和其他基于免疫的干预措施或外源性胰岛素疗法联合给药,提高整体治疗效果。”
2019 年,周如鸿团队与约翰·霍普金斯大学医学院 Abdel Rahim A. Hamad 团队合作发现了一种新的自身抗原 X-autoantigen(X-idiotype),其结合抗原呈递蛋白 HLA-DQ8(T1D 主要风险等位基因)的能力比胰岛素高出近千倍。这项研究已经以“A Public BCR Present in a Unique Dual-Receptor-Expressing Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen”为题发表在 Cell 上。

(来源:Cell)
“此次,我们最新发表的这项研究是在前期基础上围绕其分子机制进行的深入探索,主要针对 X-autoantigen 进行突变分析,优化并设计出了一系列可作为潜在疫苗的自身抗原。”周如鸿介绍说。
具体而言,他和团队运用分子动力学对自身抗原 X-autoantigen 与 HLA-DQ8 的动态相互作用进行了模拟,并采用自由能微扰进行单突变、交换突变、双重突变等,得到了可增强抗原与 HLA 结合亲和力的新突变体,他们发现,核心表位 p6 位置上的 Tyr(Tyr6)突变对增强抗原与 HLA 的结合亲和力发挥关键作用。
随后,他们进一步探索了抗原突变对 pHLA-TCR 结合的影响。通过自由能微扰计算发现,Tyr6 突变体 Y6C 和 Y6I 能增强 pHLA 与 TCR 的结合亲和力,可作为调节 TCR 功能的候选药物。此外,他们通过验证发现多个突变体对 pHLA-TCR 结合亲和力的预测效果与 CD4⁺ T 细胞增殖的实验结果一致。
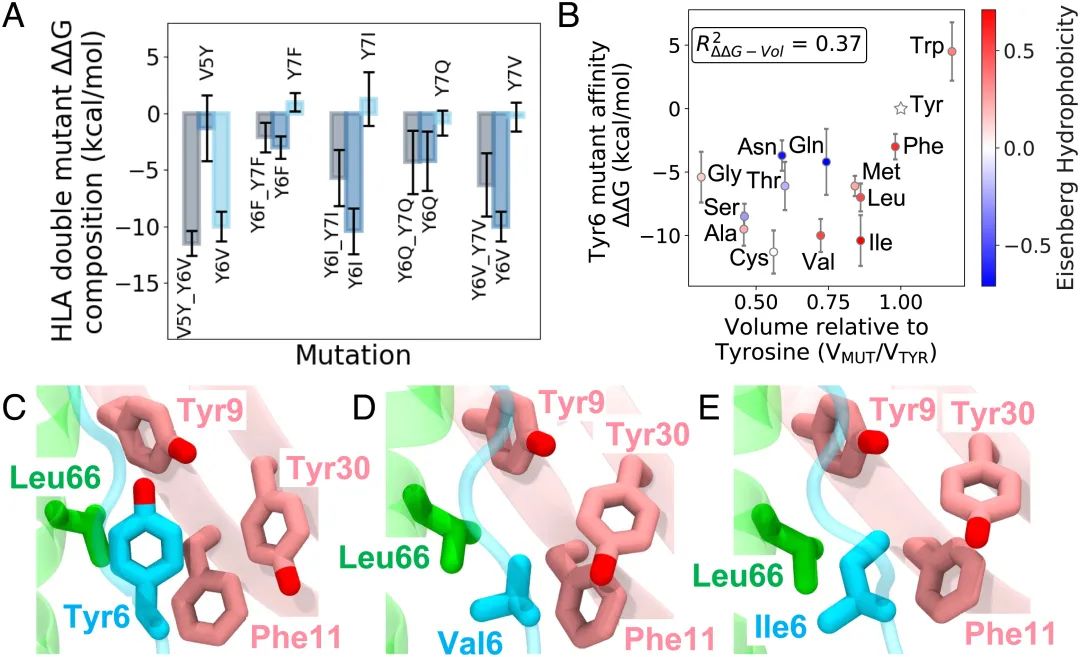
▲图|X-autoantigen 双突变分解及 Tyr6 突变的自由能变化结果(来源:PNAS)
“在理论发现的基础上,我们还通过 T 细胞增殖实验验证了这些突变体,理论与实验相结合最终优化设计出了新型抗原,为接下来开发全新自身抗原免疫疗法打下基础。”周如鸿总结道。
谈及下一步的研究动向,在周如鸿看来,“了解自身抗原 X-autoantigen 及突变体与抗原呈递蛋白相互作用的分子机制仅仅是大规模临床应用的第一步。除了转化研究中新疗法、新药面临的安全性、有效性和现有疗法的联合使用、成本等共性等问题,其他的诸如免疫耐受、开发生物标志物,以及评估治疗干预的有效性等,也都是临床推进过程中亟待解决的难点。”他指出。
除此之外,由于 T1D 是一种复杂的异质性疾病,不同人群可能有不同的免疫反应和基因谱。“开发个性化的治疗方法,考虑个体对 X-autoantigen 及其突变体的具体反应也是推广临床应用的挑战之一。因此,解决这些问题需要深刻理解 T1D 的分子机制,以及研究人员、临床医生和制药公司之间全面、紧密地合作。”他补充说。
接下来,“我们团队将继续推进围绕 T1D 的新自身抗原肽设计方面的工作。对于 HLA-DQ8 的体系,从另外一条 hybrid insulin peptide 的自身抗原肽出发,设计出多条具有 HLA 阻滞或 TCR 功能调节的自身抗原肽,并且将工作推广到 Ⅰ 类 HLA 和 GAD65 自身抗原肽体系,采用物理知识与大数据相结合的机器学习新策略,提升自抗原肽优化效率和准确性,与此同时,我们也将会与药企合作推进后续转化和药物研发。”周如鸿表示。

聚焦 AI 和计算推动精准靶向药物设计开发
进入 20 世纪后,生命科学完成了从宏观到微观的转化,以基因组成、基因表达和遗传控制为核心的分子生物学迅速崛起。“与此同时,计算机技术的发展和算力的提高使计算生物学、生物信息学、系统生物学和基因组学等分支学科成为可能。”周如鸿指出。
比如,生物学家通过计算方法来分析大规模的基因组、转录组和蛋白质组数据,从而揭示基因功能、调控网络和疾病相关基因,预测基因、蛋白质结构,并通过整合实验数据、构建数学模型和进行仿真模拟,揭示生物系统中的复杂相互作用、信号传递网络和调控机制。
在药物设计和筛选方面,研究人员可以对候选化合物进行计算机模拟,预测其与靶点的相互作用、药效和毒性,从而大幅加速药物研发过程,降低研发成本。
周如鸿课题组长期从事计算生物学、生物物理、生物化学与人工智能 + 等交叉学科等领域的研究工作,专注于借助高性能计算与人工智能机器学习新算法研究复杂体系中的生物大分子相互作用。
“我们前期开展的一项研究破解了肿瘤治疗中免疫检查点抑制剂在不同人群中存在不同响应率的谜团,发现了 HLA-B*44 基因亚型的患者有较高的存活率,而对于 HLA-B*15 基因亚型的患者不起作用甚至起反作用,这一新发现的 HLA 基因亚类成为临床免疫疗法的生物标志物。”他补充说。
目前,相关研究已经以“Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy”为题发表在 Science 上。

(来源:Science)
今年年初,周如鸿团队和合作者在 Nature 上发表了题为“Structural basis of BAM-mediated outer membrane β-barrel protein assembly”的研究论文,揭示了革兰氏阴性菌外膜 β-桶蛋白 OMP 的组装机制及其整合机器 BAM 完成底物 β-桶的折叠、关闭及释放的分子机制。
“我们利用冷冻电镜、分子动力学模拟、机器学习,结合生物化学功能实验,构建了 BAM- 底物复合物在细胞膜内的动态变化,证实了构变的生理相关性,为抑制 BAM 复合物功能的抗菌药物研发提供了重要的动态结构信息,并为靶向耐药菌干预提供了药物筛选的潜在靶点。”他介绍说。

(来源:Nature)
技术转化层面,周如鸿表示,“我们团队专注于通过研究蛋白质折叠和相互作用解析其功能,通过 AI 机器学习、分子模拟和多尺度建模,设计特定结构和功能的蛋白质、短肽和化学小分子,我们很多研究成果都具有广阔应用前景。”
据介绍,周如鸿团队曾和诺华、拜耳等大型药企,以及玛氏、可口可乐等大型食品公司都有过紧密合作。“此外,我们团队与麻省总医院合作设计的 HIV/AIDS 疫苗已经进入临床前试验阶段,与一家大型食品公司合作设计的味觉添加剂已经成功量产并进入市场销售。”他说道。
“回国后,我们已经在恶性肿瘤免疫新生抗原设计、重大传染病的药物筛选与设计、阿尔茨海默病的分子机制及针对性纳米药物研发等领域,与百度、壁仞科技、药明生物等头部企业,以及浙江大学第一附属医院、浙江大学附属邵逸夫医院、深圳罗湖医院等医疗机构开展项目合作,共同开发新药物、新疗法,推动国内精准药物设计与相关重大疾病的诊疗及其产业化的发展。”他总结道。
参考资料:
1.https://doi.org/10.1073/pnas.2214430120
2.https://doi.org/10.1016/j.cell.2019.05.007
3.https://doi.org/10.1126/science.aao4572
4.https://doi.org/10.1038/s41586-023-05988-8
5.https://www.zju.edu.cn/2023/0413/c32861a2741675/page.htm


