阿尔茨海默症(Alzheimer Disease,AD),俗称老年性痴呆,是老年人常见的神经系统变性疾病,多发于65岁以上的人群。AD的病理特征有老年斑、神经元纤维缠结、海马锥体细胞颗粒空泡变性和神经元缺失等。AD发病隐匿,临床表现主要包括:认知损害症状、非认知性神经精神症状及社会生活功能减退3个方面。尽管有越来越多的证据表明AD的发病与Aβ肽的聚集和Aβ寡聚物的出现有关,但在过去几十年中,经美国食品药品监督管理局批准的抗聚集疗法药物却寥寥无几。2023年9月15日,浙江大学上海高等研究院周如鸿教授团队在Nature Communications最新发表的“C3N Nanodots Inhibits Aβ Peptides Aggregation Pathogenic Path in Alzheimer's Disease”研究工作中,报道了一种新型Aβ多肽聚集抑制剂:超小型C3N纳米点。该项工作通过结合科学实验和多尺度理论计算,从分子、细胞、动物层面系统地研究了C3N纳米点抑制Aβ多肽聚集,干预AD小鼠病理过程的生物学效应及详细的分子机制,为开发高效、低毒的抗AD药物提供了重要新思路。

通过经典的硫黄素T(ThT)荧光实验、点杂交实验和AFM形貌观察,研究人员发现C3N纳米点可以高效地抑制Aβ42肽的聚集(图1b-d)。同时,他们通过Aβ42肽刺激的原代神经元模型证明C3N纳米点可以缓解Aβ42肽聚集过程诱导的神经毒性。此外,C3N纳米点也能有效阻止Aβ多肽家族中其他片段的聚集,包括N-截短的Aβ多肽(AβpE3)和Aβ40多肽。为了进一步探索C3N纳米点抑制Aβ聚集的分子机制,他们还利用全原子分子动力学(MD)模拟研究揭示了C3N纳米点在Aβ42聚集过程中的结构调节作用。结果显示C3N纳米点可以明显抑制Aβ42肽链自组装过程中有序的β片层结构的形成,转而诱导其形成无序的结构(图1e-f)。C3N与肽链之间相互作用分析结合关键的结合构象详述了两者之间具体的结合机制。此外,他们还比较分析了C3N纳米点、纳米石墨烯(GRA)和富勒烯(C60)分别对Aβ42聚集的抑制作用,结果表明C3N纳米点抑制Aβ42聚集的能力更强。
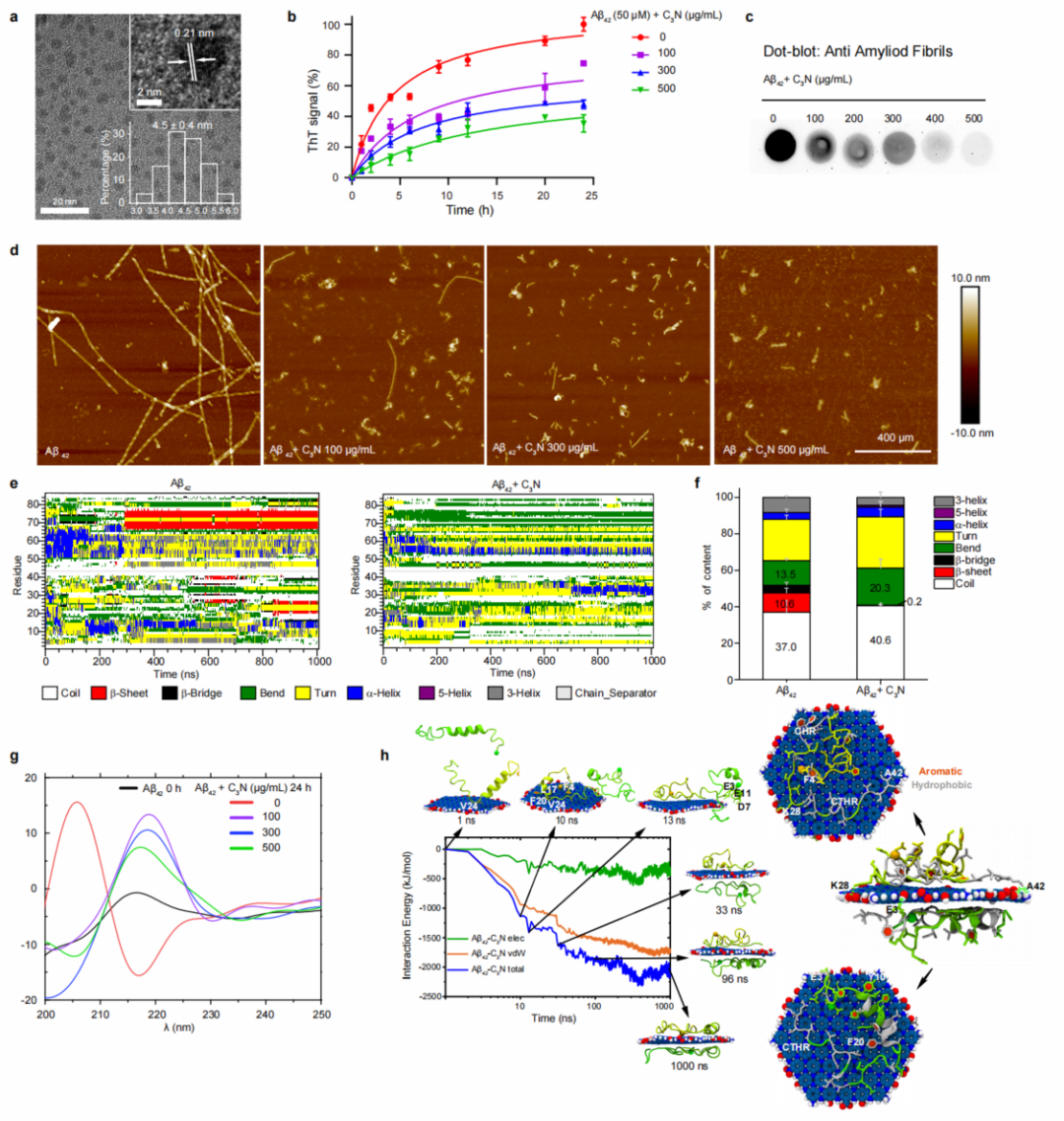
图1:C3N纳米点抑制体外Aβ42纤维化。(a)C3N纳米点的电镜图;(b)ThT荧光实验检测β片层的含量;(c)点杂交实验检测成熟纤维含量;(d)AFM观察形貌。(e)Aβ42肽链中残基二级结构随模拟时间的演变,及(f)各结构组分的比例。(g)Aβ42在C3N纳米点处理前后的CD谱图。(h)C3N纳米点与Aβ42之间的非键相互作用能以及在此过程中的关键结合构象。
鉴于AD的典型临床症状为认知功能缺陷,周如鸿团队随后通过Cy5.5标记C3N纳米点,证明其可以通过小鼠的血脑屏障。进一步通过水迷宫实验发现,C3N纳米点给药(1mg/kg/d)可以明显缩短AD小鼠找到隐藏平台的时间;撤去平台后,C3N纳米点干预的AD小鼠在目标区域的停留时间和穿过次数明显增多(图2b-f)。在新物体识别实验中,C3N纳米点给药提高了AD小鼠的新物体探索时间(图2g-h)。这些结果一致表明,C3N纳米点给药改善了AD小鼠的学习和记忆缺陷。
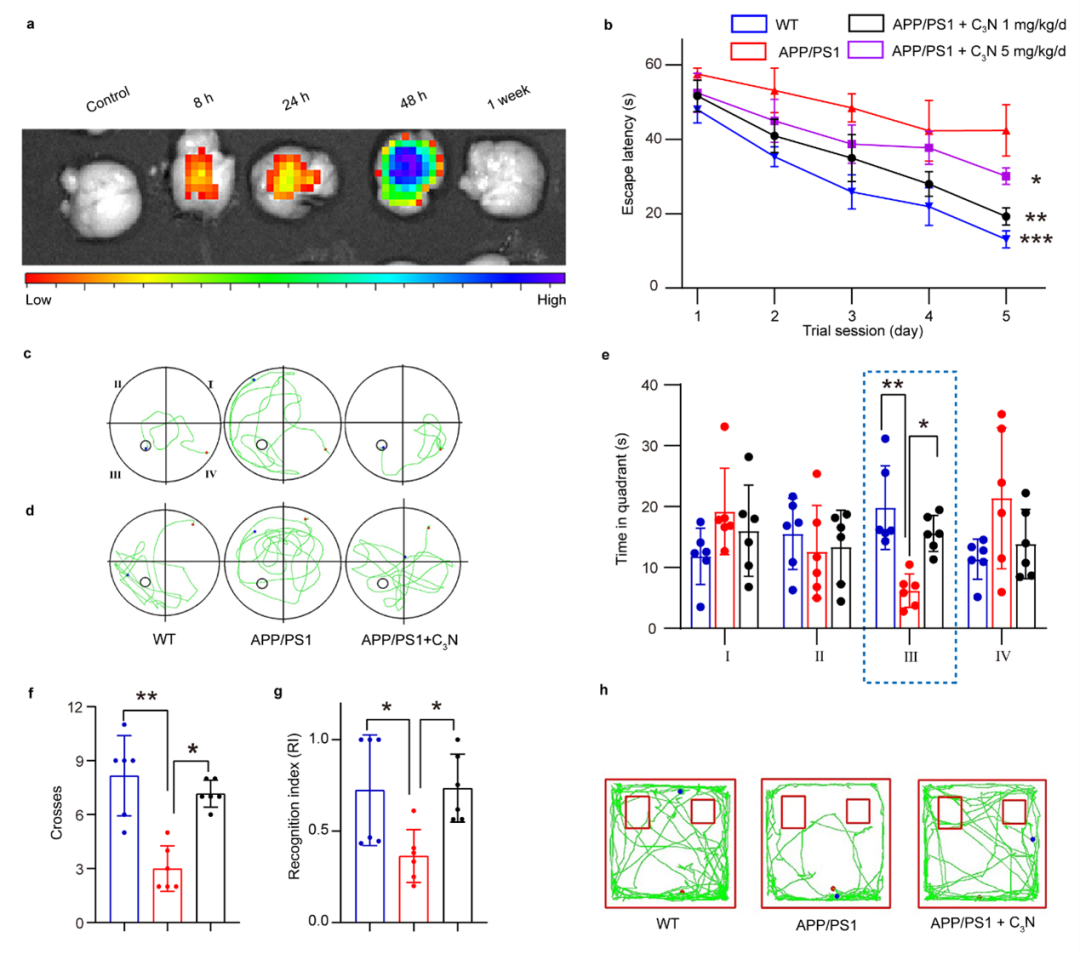
图2:C3N纳米点改善AD小鼠的认知功能障碍。(a)小鼠大脑中C3N-Cy5.5荧光强度;(b-c)小鼠定向巡航实验;(d-f)小鼠空间探索实验;(g-h)新物识别实验。
最后,研究人员在小鼠脑切片和脑匀浆中还发现C3N纳米点降低了AD小鼠大脑中的Aβ多肽积聚,进而缓解了AD小鼠的神经元突触损伤以及神经元死亡(图3)。这些结果进一步证明了C3N纳米点通过抑制Aβ多肽聚集可以有效改善AD病理。
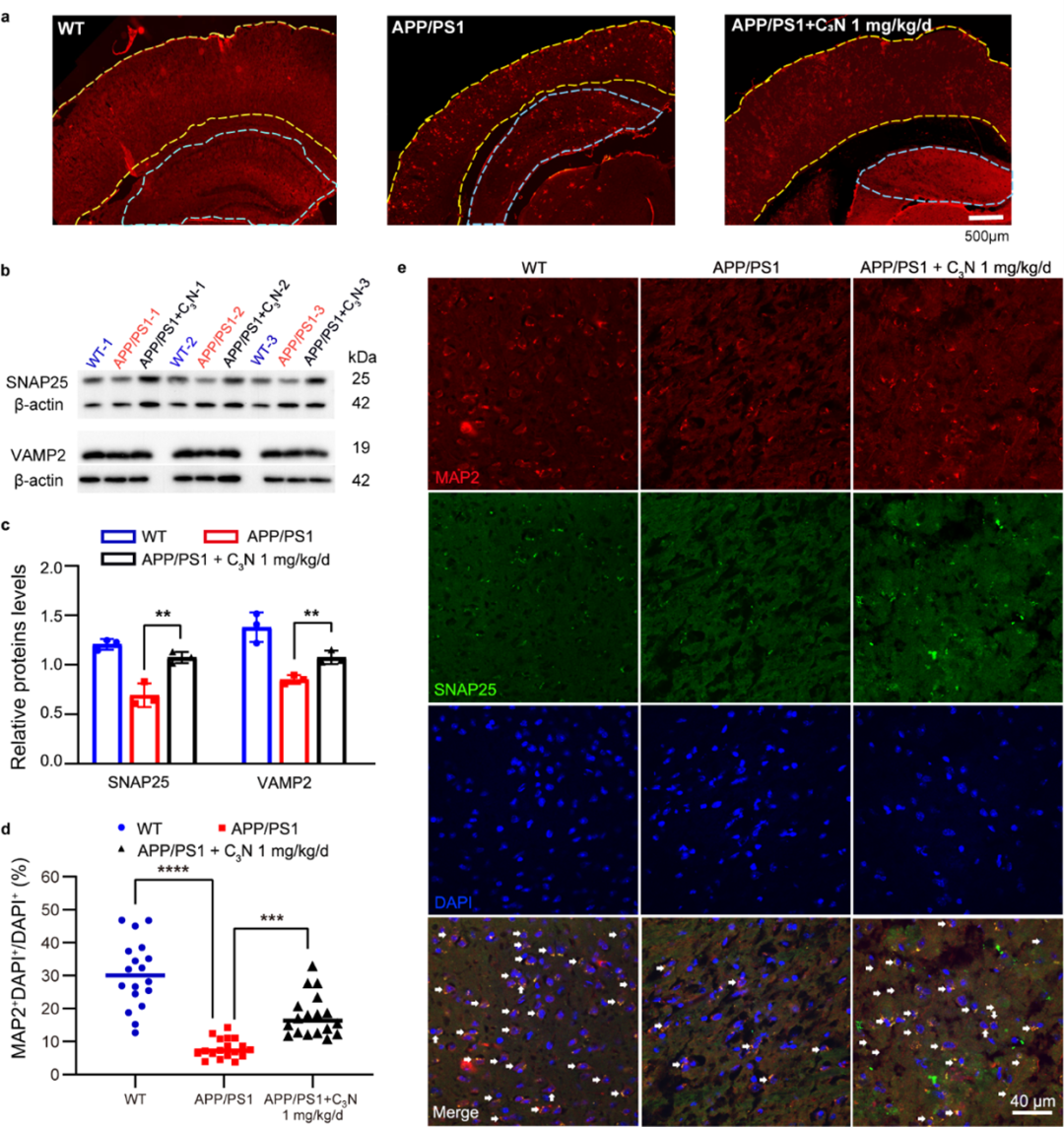
图3:C3N纳米点缓解AD小鼠病理。(a)C3N纳米点减少AD小鼠大脑中的Aβ沉积;(b-e)C3N纳米点缓解小鼠脑内神经元丢失以及突触损伤。
综上所述,该研究报告了一种C3N纳米点可以减轻Aβ聚集诱导的神经元细胞毒性,降低全脑Aβ肽水平并有效阻止AD小鼠的突触损失。基于上述功能,C3N纳米点能显著改善APP/PS1双转基因雄性AD小鼠的行为缺陷。值得注意的是,C3N纳米点具有良好的生物安全性,小鼠给药长达半年,未检测出炎症反应以及主要脏器损伤。该研究为C3N 纳米点在AD防治中的应用提供了有益的实验和理论依据,并且对后续抑制Aβ聚集的AD药物设计具有重要参考价值。
本工作是神经生物学、纳米医学和计算生物学多学科领域交叉融合的研究成果,得到了国家重点研发计划、国家自然科学基金、国家自主创新示范区上海张江重大专项、浙江大学上海高等研究院繁星科学基金等资助。
原文链接:https://www.nature.com/articles/s41467-023-41489-y


